Blog Archive
-
2012
(22)
-
setembro(22)
- II Fórum Mundial de Educação Profissional e Tecnol...
- Química e Arte
- Chem Toddler
- Estradiol
- Cloridrato de Sertralina
- Cromatografia em Papel com Etanol
- Wallpapers
- Monstro de Açúcar (Desidratação da Sacarose)
- Vulcão de Coca-Cola A grande pergunta ...
- Espelho de Prata - Reagente de Tollens Nes...
- Como fazer uma pilha Uma pilha, em termo...
- Cafeína
- Nicotina
- Teobromina
- Paracetamol
- Efedrina
- Fireball
- Pasta de dente de elefante
- A bolinha que quica
- O Efeito Joule
- Ácido acetilsalicílico (Aspirina®)
- Apresentação
-
setembro(22)
Arquivo do blog
-
▼
2012
(22)
-
▼
setembro
(22)
- II Fórum Mundial de Educação Profissional e Tecnol...
- Química e Arte
- Chem Toddler
- Estradiol
- Cloridrato de Sertralina
- Cromatografia em Papel com Etanol
- Wallpapers
- Monstro de Açúcar (Desidratação da Sacarose)
- Vulcão de Coca-Cola A grande pergunta ...
- Espelho de Prata - Reagente de Tollens Nes...
- Como fazer uma pilha Uma pilha, em termo...
- Cafeína
- Nicotina
- Teobromina
- Paracetamol
- Efedrina
- Fireball
- Pasta de dente de elefante
- A bolinha que quica
- O Efeito Joule
- Ácido acetilsalicílico (Aspirina®)
- Apresentação
-
▼
setembro
(22)
Tecnologia do Blogger.
sábado, 15 de setembro de 2012
Durante cinco dias, o II Fórum Mundial de Educação Profissional e Tecnológica contará com palestras, debates, oficinas, o Show de Inovação Tecnológica, o Show de Artes Visuais, cartazes, Feira de Alimentação, Feira de Solidariedade, Economia e Feira do Livro.
O tema desta edição será Emancipação Democratização e Sustentabilidade.
Noventa e sete artistas de vários países uniram para, recorrendo a diferentes técnicas,produzirem 118 gravuras, cada uma inspirada num elemento químico.
O resultado final é uma belíssima tabela periódica de elementos destinados a promover aciência e as artes.
 |
      |
Clique aqui para acessar o site!
O Chem Toddler é um site que traz vídeos de experimentos organizados por tema ou por ordem alfabética e também conta com uma área de notícias sobre o mundo da Química.
Clique aqui para acessar o site!
Hormônios são substâncias químicas que transferem informações e instruções entre as células, em animais e plantas. Também chamados de "mensageiros químicos do corpo", os hormônios regulam o crescimento, o desenvolvimento, controlam as funções de muitos tecidos, auxiliam as funções reprodutivas, e regulam o metabolismo (o processo usado pelo organismo para produzir energia a partir dos alimentos). Diferentemente das informações enviadas pelo sistema nervoso, que são transmitidas via impulsos elétricos, se deslocam rapidamente, têm um efeito quase imediato e de curto prazo, os hormônios são mais vagarosos e seus efeitos mantêm-se por um período mais longo de tempo.
O estradiol é um hormônio sexual, da classe dos esteróides, produzido pelos folículos ovarianos. O estradiol é responsável pela manutenção dos tecidos do organismo, garantindo a elastidade da pele e dos vasos sanguíneos, a reconstituição dos ossos, a proteção de funções cerebrais como a memória, entre outras 300 atividades, segundo informam os estudos científicos. O Estradiol também está presente nas pílulas anticoncepcionais.
Referências:
http://www.netdrugs.info/dci/estrad.shtml- acesso em 27/10/2011.
http://pt.wikipedia.org/wiki/Estradiol- acesso em 27/10/2011.
http://www2.uol.com.br/menospausa/mudhorm1.html - acesso em 27/10/2011.
A Sertralina (Tolrest) é um dos antidepressivos mais utilizados atualmente no Brasil, perde somente para a Fluoxetina (Prozac). Tanto a Sertralina quanto a Fluoxetina são usados não somente para o tratamento da depressão e distimia como também associados a anfetaminas no tratamento da obesidade.
Apesar de sua grande utilização, os estudos apontam a Sertralina como pouco mais eficaz que um placebo no tratamento da depressão. No entanto, é recomendável sua utilização em quadros de distimia, devido a baixa ocorrência de efeitos colaterais.Ela não interage com o álcool, mas seu consumo concomitante deve ser evitado.
Em comparação com a Fluoxetina, a Sertralina possui baixo índice de Suicidalidade. Este índice mede o efeito indutório ao pensamento suicida ou ao ato em si em pacientes até 25 anos.
Funcionamento:
A Sertralina é um inibidor da receptação de serotonina. Atua diretamente nos transportadores inibindo seu funcionamento. As doses de 5mg já provocam a inibição de até 50m% desses transportadores.
Seu uso associado a anfetaminas e inibidores de apetite de um modo geral é contra indicado, pois as interações medicamentosas causam risco hepático e atrapalham a função tanto de um medicamento quanto do outro.
Por Máslova Rodrigues
http://pt.wikipedia.org/wiki/Sertralina, acesso em 30/10/2011
30/10/2011
A cromatografia acontece pela passagem de uma mistura através de duas fases: uma estacionária (fixa) e outra móvel. A grande variabilidade de combinações entre a fase móvel e estacionária faz com que a cromatografia tenha uma série de técnicas diferenciadas.
A cromatografia em papel é a utilizada nesse experimento. Esta , utiliza dois líquidos, um atuando como fase móvel (eluente) e outro, colocado no papel, atuando como fase estacionária. A faze estacionária interage tanto com o papel quanto com o eluente, e devido as diferenças de interações dos diversos compostos presentes na faze estacionária com o solvente da faze móvel é que ocorre a separação. Utiliza-se papel normal ou papel de filtro (mais utilizado) como suporte da fase estacionária.
Exemplificando: a mistura é aplicada no papel e mergulhada fases líquida. Esta fase móvel (solvente) sobe por capilaridade e arrasta a substância pela qual tem mais afinidade, separando-a das substâncias com maior afinidade pela fase estacionária. Como a maioria das substâncias separadas são incolores, utiliza-se um revelador. As manchas podem ser reveladas por meio de luz UV, vapores de iodo, soluções de cloreto férrico e tiocianoferrato de potássio, fluorescências, radioatividade, etc.
Neste experimento utilizamos canetinhas coloridas, etanol e papel de filtro para café.
Por Máslova Rodrigues
Referências:
Desidratação da sacarose pelo ácido sulfúrico
O ácido sulfúrico é um poderoso desidratante. Ao entrar em contato com o açúcar comum,sacarose,ele retira átomos de hidrogênio e de oxigênio sob a forma de água,carbonizando o material. À medida que a reação prossegue,o material vai escurecendo,indicando que carbono vai se formando. Ao final, o calor liberado na reação é suficiente para vaporizar a água que,ao escapar,vai criando espaços vazios no interior da massa de carbono.Isso explica o aumento de volume do material sólido.
Por Júnia Barreto
Referências:
http://www.idealvestibulares.com.br/quimica/conteudo.ler.php?sc=831&ct=35745
Vulcão de Coca-Cola
A grande pergunta desse vídeo é: Por que a coca cola explode quando se joga Mentos? A resposta é simples, por causa do Ácido Carbônico (H2CO3). Pera aí? Ácido? Então coca-cola faz mal?
Não. O Ácido Carbônico é o gás do refrigerante. Na fabricação de qualquer bebida gaseificada o gás carbônico (CO2) é misturado sob alta pressão e se associa a água, formando o Ácido Carbônico. Essa reação é facilmente reversível, mas a garrafa mantêm a pressão necessária para que o ácido seja mantido.
Quando abrimos a garrafa, aos poucos o ácido se decompõe em água e CO2, de forma lenta e controlada. No entanto, quando adicionamos um sólido ao sistema, as bolhas de CO2 se acumulam ao redor dele, formando bolhas maiores e capazes de carregar consigo uma grande quantidade de liquido. Caso esse sólido tenha substancias capazes de interagir fortemente com a água, como glicose, alguns corantes e goma arábica, a dissociação do ácido carbônico é acelerada, formando bolhas maiores ainda. Essas substancias também quebram a tensão superficial facilitando o escape das bolhas.
A explosão ocorre quando muitos sólidos com substancias capazes de interagir com a água são adicionados ao refrigerante, formando muitas bolhas de grande volume capazes de arrastar consigo grande quantidade de liquido a uma certa altura.
Por Máslova Rodrigues
Fontes:
http://pt.wikipedia.org/wiki/Goma-ar%C3%A1bica, acesso 30/10/2011
http://pt.wikipedia.org/wiki/%C3%81cido_carb%C3%B4nico, acesso 30/10/
Espelho de Prata - Reagente de Tollens
Neste experimento explora-se a redução do íon prata (Ag+) á prata sólida pela glicose, com a finalidade de produzir um espelho de prata. Para tal, inicie por preparar o reagente de Tollens.
O reagente de Tollens consiste numa solução amoniacal de nitrato de prata obtida a partir de uma reação entre as soluções de nitrato de prata e hidróxido de sódio com formação de óxido de prata que, por sua vez, reage com o amoníaco originando o íon complexo diaminoprata [Ag(NH3)2]+. As reações que ocorrem na preparação no reagente de Tollens podem ser traduzidas pelas seguintes equações químicas:
2 AgNO3 (aq) + 2 NaOH (aq) → Ag2O (s) + H2O (l) + 2 NaNO3 (aq)
Ag2O (s) + 4 NH3 (aq) + H2O (l) → 2 Ag(NH3)2OH (aq) (Reagente de Tollens)
Após a preparação do reagente de Tollens basta adicionar uma pequena quantidade de glicose. Esta substância quando em contacto com o reagente de Tollens oxida-se a um ácido carboxílico, reduzindo, por sua vez, o íon prata do complexo
Esta reação é a essência de um processo de fabricação de espelhos.
A razão pela qual se adiciona uma solução de amoníaco à solução de nitrato de prata é para diminuir o potencial de redução de eletrodo padrão do íon Ag+.
Ag+ (aq) + e- → Ag (s) E0 = + 0,799 V Ag(NH3)2+ (aq) + e- → Ag (s) + 2NH3 (aq) E0 = + 0,373 V |
0,373 V |
Estas semi-equações indicam que o amoníaco forma um complexo com o íon Ag+, que é mais difícil de reduzir do que ele próprio. Com esta diminuição do potencial de redução de eletrodo padrão do íon Ag+, forma-se um espelho de prata ainda mais bonito. A adição de uma solução de amoníaco à solução de nitrato de prata tem apenas uma finalidade estética.
Caso não se adicionasse a solução aquosa de amoníaco, o íon Ag+ era reduzido tão rapidamente pela glicose que surgiria uma solução coloidal deste metal, isto é, a solução se transformaria num líquido nublado e negro.
A adição de solução aquosa de hidróxido de sódio, além de servir para formar um intermediário que ao reagir com a solução de amoníaco origina o complexo pretendido, serve também para tornar a mistura ainda mais básica, dado que a glicose oxida-se mais facilmente em meio básico.
Por Júnia Barreto, Marianne Viana, Mariane Neri, Máslova Rodrigues e Lucas Rodrigo
Referências:
Acesso em 30/10/2011
Como fazer uma pilha
Uma pilha, em termos simples, é um cátodo (a ponta positiva), um ânodo (a ponta negativa) e um eletrólito (a parte do meio). Há muitas combinações diferentes no mercado. A eletricidade é o movimento dos elétrons, partículas minúsculas com carga negativa. O ânodo costuma ser feito de alguma substância capaz de ceder elétrons com facilidade, como o zinco, que cede dois elétrons a cada átomo. O cátodo costuma ser feito de alguma substância que aceite elétrons com facilidade, como o cobre. O eletrólito lá dentro pode ser um líquido, um gel ou uma pasta. O importante é que contenha íons com carga positiva e negativa que possam fluir quando o ânodo e o cátodo forem ativados. Quando o físico italiano Alessandro Volta fez a primeira pilha, usou cobre no cátodo, zinco no ânodo e um eletrólito de papel mata-borrão com água do mar. O seu nome nos deu a palavra “volt", como na bateria de 12 volts dos carros. Se você pensar na eletricidade como se fosse um cano d'água, o volt mediria a velocidade da água, mas também é preciso um buraco grande por onde fluir, que é medido em “amperes". Pode-se ter voltagem suficiente para deixar o cabelo em pé, mas, sem amperejar ela só vai provocar uma fagulhinha. No entanto, a eletricidade doméstica, no Brasil, tem 110 ou 220 volts e amperagem suficiente para matar uma pessoa.
Pilha de Moedas
VOCÊ VAI PRECISAR DE:
•Vinte moedas de cinco centavos - as de cobre.
•Papel de alumínio de cozinha.
•Papel filtro ( filtro de café )
•Dois pedaços de fio de cobre (tirados de qualquer fio elétrico).
•Vinagre.
•Sal.
•Tigela.
•Um LED, diodo emissor de luz (você o encontra em lojas de ferragem e de modelismo).
•Fita-crepe.
A moeda de cobre será o cátodo, o papel de alumínio, o ânodo. Corte o papel alumínio e o papel filtro em círculos, para empilhá-los uns sobre os outros. O papel filtro será encharcado de vinagre, e também servirá para impedir que os metais se toquem; assim, corte os círculos de papel filtro um pouco maiores do que o papel de alumínio e as moedas.
1. Na tigela, misture o vinagre com um pouco de sal. O vinagre é ácido acético e todos os ácidos podem ser usados como eletrólitos. Na bateria dos carros, usa-se ácido sulfúrico mas não se deve brincar com um produto tão forte. Ele corrói a roupa e queima a pele, ao contrário do vinagre, que você também põe na salada. O sal de cozinha é cloreto de sódio, combinação de um íon positivo com outro negativo (Na+ e Cl-). No eletrólito, vão se separar e aumentar a sua potência.
2. Embeba os círculos de papel filtro no eletrólito cheio de íons.
3. Com fita-crepe, prenda uma ponta de fio na parte de baixo de um disco de papel de alumínio. Este é o terminal negativo. Agora, faça a pilha na seguinte seqüência: papel de filtro, moeda, papel de alumínio, filtro, moeda. Cada combinação é uma pilha minúscula, porém para acender um LED você vai precisar de várias.
Uma bateria de carro costuma ter seis delas, mas com "células" de superfície muito maior. Como regra geral, quanto maior a pilha, mais potência ela tem. (A potência é medida em watts= ampéres x volts). Todos os íons positivos irão para um terminal e todos os íons negativos para o outro. De fato, você está carregando a sua pilha.
4. Depois de fazer a pilha, prenda o outro fio na moeda de cima com a fita-crepe. Este será o terminal positivo. Agora você pode acender um LED, ou, se tiver pilhas de moedas em quantidade suficiente, até uma lâmpada pequena.
Talvez ainda inventem pilhas de nova geração, mas se você entender a pilha que acabo de ensinar a fazer, irá entender qualquer tipo de pilha ou bateria existente hoje, seja de níquel-cádmio, lítio, seja a bateria recarregável do celular ou aquelas que a gente usa em brinquedos.
Por Júnia Barreto
Referências:
http://revisaovirtual.com/site/Artigos_213_como_fazer_uma_pilha.htm , acesso em 30/10/2011
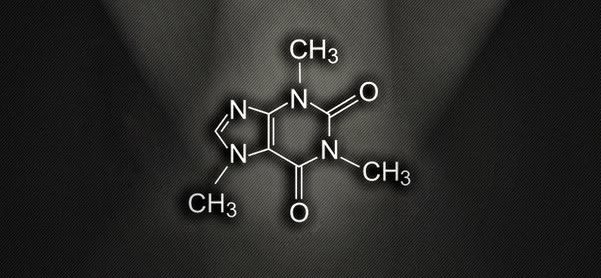
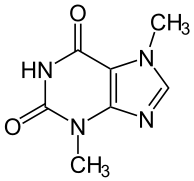
A cafeína é um composto químico de fórmula C8H10N4O2 — classificado como alcalóide do grupo das xantinas e designado quimicamente como 1,3,7-trimetilxantina. É encontrado em certas plantas e usado para o consumo em bebidas, na forma de infusão, como estimulante.
A cafeína é uma droga psicotrópica (drogas psicotrópicas são substâncias que alteram o funcionamento do sistema nervoso). Ela age no sistema nervoso autônomo como estimulante, produzindo um estado de excitação. Este fato explica porque o café ajuda as pessoas a despertarem pela manhã. Mas assim como ela produz esta sensação de energia e disposição, ela também pode provocar maior irritabilidade e ansiedade em seus usuários.
Entretanto, ser dependente de cafeína não significa necessariamente um dano à saúde, pois muitas pessoas vivem uma vida perfeitamente saudável com pequenas doses diárias desta substância. Porém, quando seu consumo é elevado, ela pode aumentar seriamente o nível de estresse diário.
A cafeína é a droga mais consumida no planeta e é encontrada no café, chá preto, chá mate, bebidas a base de cola, guaraná e chocolate. Como qualquer substância alcalóide (exemplo: nicotina, teobromina, teofilina, etc) ela cria reações agradáveis no cérebro e, conseqüentemente, este solicitará outras doses.
A cafeína é uma droga psicotrópica (drogas psicotrópicas são substâncias que alteram o funcionamento do sistema nervoso). Ela age no sistema nervoso autônomo como estimulante, produzindo um estado de excitação. Este fato explica porque o café ajuda as pessoas a despertarem pela manhã. Mas assim como ela produz esta sensação de energia e disposição, ela também pode provocar maior irritabilidade e ansiedade em seus usuários.
Entretanto, ser dependente de cafeína não significa necessariamente um dano à saúde, pois muitas pessoas vivem uma vida perfeitamente saudável com pequenas doses diárias desta substância. Porém, quando seu consumo é elevado, ela pode aumentar seriamente o nível de estresse diário.
Referências
http://pt.wikipedia.org/wiki/Cafe%C3%ADna - Wikipédia - acessado em 29/10/2011.
http://www.scielo.br/scielo.php?pid=S0101-20611998000400012&script=sci_arttext&tlng=es - acessado em 29/10/2011.
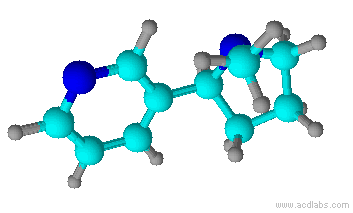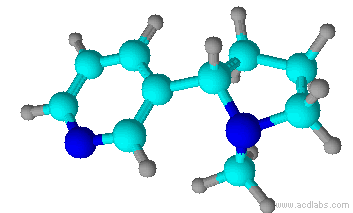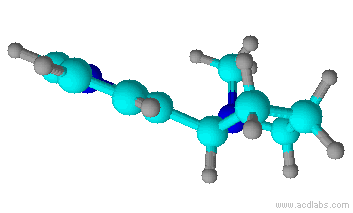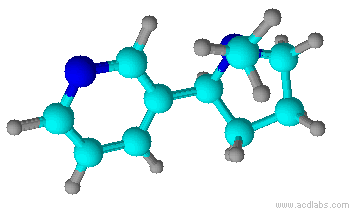
A nicotina é um composto orgânico, e é o principal alcalóide do tabaco. (Alcalóides são compostos orgânicos nitrogenados provindos de plantas, que tem efeitos fisiológicos nos seres humanos). A nicotina está presente em toda a planta do tabaco, mas principalmente nas folhas, correspondendo a 5% em peso da planta. Tanto o tabaco (Nicotiana tabacum) quanto à nicotina foram denominadas por Jean Nicot, um embaixador de Portugal, que enviou sementes de tabaco para Paris, em 1550.
A nicotina em estado bruto já era conhecida em 1571, e o produto purificado foi obtido em 1828. A fórmula molecular, C10H14N2, foi estabelecida em 1843, e a primeira síntese em laboratório foi publicada em 1904. A nicotina é um dos poucos alcalóides líquidos, à temperatura ambiente. É um líquido incolor e inodoro, oleoso; quando exposto ao ar ou à luz, adquire uma coloração marrom e um odor característico do tabaco.
A nicotina em estado bruto já era conhecida em 1571, e o produto purificado foi obtido em 1828. A fórmula molecular, C10H14N2, foi estabelecida em 1843, e a primeira síntese em laboratório foi publicada em 1904. A nicotina é um dos poucos alcalóides líquidos, à temperatura ambiente. É um líquido incolor e inodoro, oleoso; quando exposto ao ar ou à luz, adquire uma coloração marrom e um odor característico do tabaco.
A fumaça do cigarro contém várias substâncias carcinogênicas, como o mitroso nornicotina, monóxido de carbono, acroleína, benzeno, tolueno, cresol, fenol, cloreto de vinila, benzoantraceno, benzopireno, etc. Essas substâncias foram detectadas no tabaco através de análises químicas conduzidas pelos pesquisadores Hoffmann e Brunnemann, em 1976/77.
Algumas companhias tabagistas já foram acusadas de adicionarem amônia aos cigarros, numa tentativa de aumentar a liberação de nicotina. Este processo é conhecido como "free-basing", que é semelhante ao processo utilizado para aumentar os efeitos da cocaína. Com a adição de amônia, toda a nicotina fica na forma básica, que é mais volátil que a forma ácida (protonada).
Enfrentamos dois fatos: o fumo do cigarro contém substância farmacologicamente ativa”. A nicotina é um agente farmacológico potente. Todos os toxicólogos, fisiologistas, médicos e a maioria dos químicos, os sabem. “Não é nenhum segredo”.
Phillip Morris, 1982
“Na atualidade consomem-se diariamente 200 toneladas de nicotina, totalizando 73 mil toneladas por ano. Há no mundo mais de 1 bilhão e 200 milhões de fumantes consumidores de nicotina. Estima-se que 2 bilhões de pessoas não-fumantes inalam nicotina por viverem expostas à poluição tabágica ambiental. Mais da metade da humanidade inala nicotina diretamente quando são fumantes e indiretamente quando convivem com fumantes. Há no mundo em torno de 1 bilhão de pessoas dependentes da nicotina”.
Organização Mundial da Saúde
Organização Panamericana de Saúde
U.S. Department of Health and Human Services
Convenção Quadro Internacional de Controle do Uso do Tabaco
1999, 2000, 2003
Referências:
http://www.qmc.ufsc.br/qmcweb/artigos/nicotina.html acesso em 07/10/11
http://www.inca.gov.br/tabagismo/publicacoes/nicotina.pdf acesso em 07/10/11
http://www.qmc.ufsc.br/qmcweb/artigos/nicotina.html acesso em 07/10/11
http://www.inca.gov.br/tabagismo/publicacoes/nicotina.pdf acesso em 07/10/11
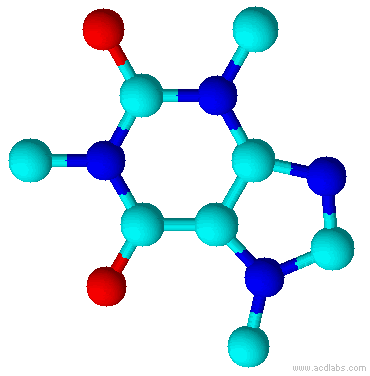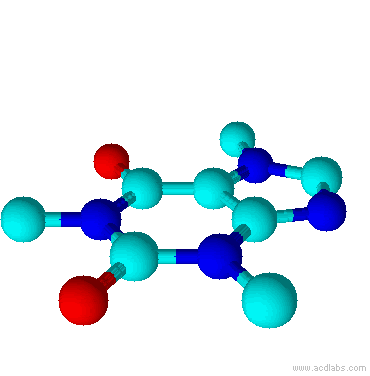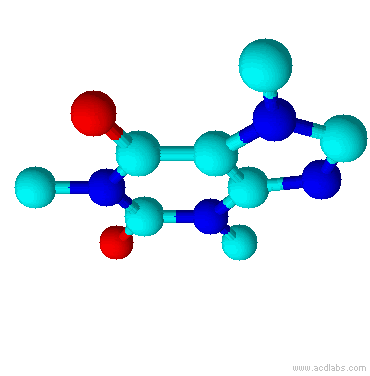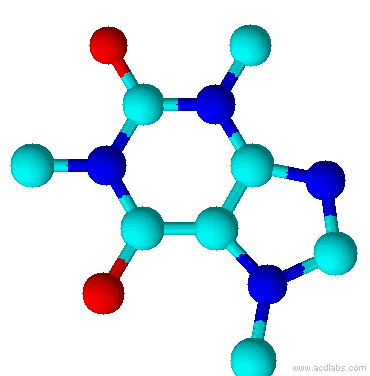
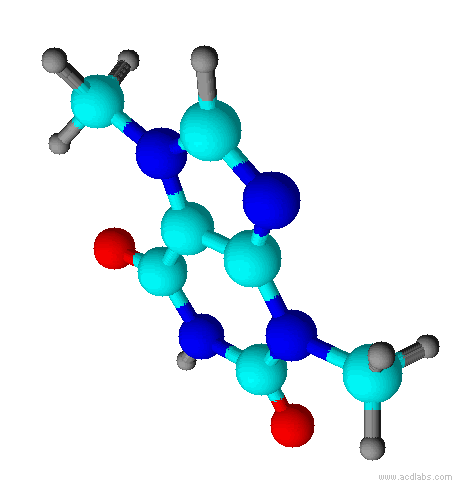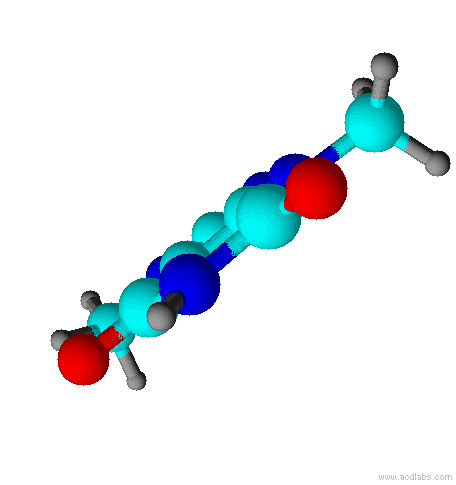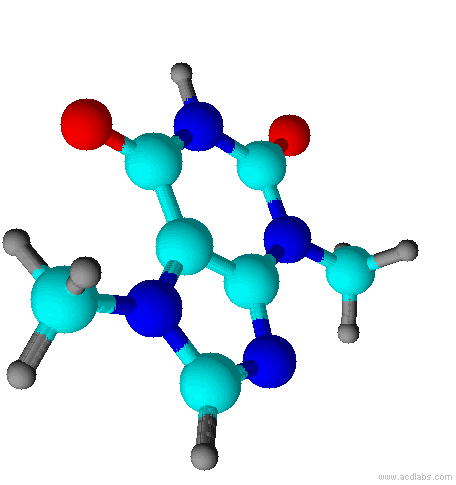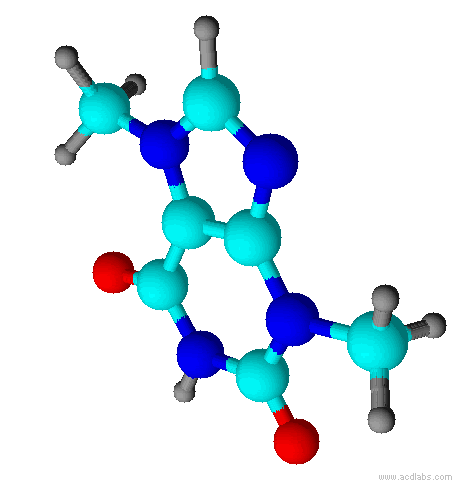
Teobromina é um alcalóide da família das metil-xantinas, da qual também fazem parte a teofilina e a cafeína. Substância normalmente encontrada no fruto do Theobroma cacao, e por isso esse composto é normalmente encontrado no chocolate. Está presente também na semente do guaraná.
As plantas com maiores quantidades são:
Theobroma cação
Theobroma bicolor
Ilex paraguariensis
Camellia sinensis
Cola acuminata
Theobroma angustifolium
Paullinia cupana
Coffea arabica
Depois de sua descoberta no final do século 19, a teobromina foi posta à use em 1916, onde foi recomendado pelos Princípios de publicação de Tratamento Médico como um tratamento para edema (líquido excessivo em partes do corpo), ataques de angina sifilítica, e angina degenerativa. O Diário americano de Nutrição Clínica diz que a teobromina era uma vez usada como tratamento para outros problemas circulatórios inclusive arteriosclerose, certas doenças vasculares, de angina pectoris, e hipertensão.
Na medicina moderna, a teobromina é usada como um vasodilator (um alargador de vaso sanguíneo), uma ajuda para eliminar a urina e estimulante do coração. Além disso, o uso futuro de teobromina em campos de prevenção de câncer foi patenteado.
No fígado humano, a teobromina é metabolizada em metilxantina e subseqüentemente em ácido metilúrico.
Organismo humano
Mesmo que a teobromina e a cafeína sejam semelhantes por serem alcalóides relacionados, a teobromina tem menos impacto no sistema nervoso central e estimula o coração em um maior grau. Ainda que a teobromina não seja uma substância viciante, foi apontada como causadora do vício por chocolate. O chocolate é considerado afrodisíaco, pois seus efeitos incluem os efeitos estimulativos da teobromina: prazer induzido pelo hipotálamo, como o efeito da doçura de chocolate e natureza gordurosa, ou como o chocolate afeta os níveis de serotonina. Enquanto a serotonina tiver um efeito aprazível, em concentrações altas pode ser convertida à melatonina que em quantias grandes aumenta o apetite sexual.
Como é um estimulante do miocárdio, como também um vasodilator, aumenta as batidas do coração, contudo também dilata os vasos sanguíneos, enquanto diminui a pressão sanguínea. Porém, um recente artigo publicado sugere que a diminuição da pressão sanguínea pode ser causada através de flavanols. Além disso, seu efeito de drenagem permite isto ser usado para tratar falência cardíaca que pode ser causada por uma acumulação excessiva de fluido.
Um estudo publicado em 2005 pela Faculdade Imperial de Londres concluiu que a teobromina tem uma substância que reduz a tosse, efeito superior à codeína, suprimindo atividade do nervo vago. Além do mais, a teobromina é útil em tratamentos de asma sendo que relaxa os músculos, inclusive os achados nos brônquios.
Há uma possível associação entre teobramina e um risco aumentado de sofrer de câncer de próstata.
Teobromina pode causar insônia, tremores, inquietude, ansiedade, como também contribui para produção aumentada de urina. Efeitos colaterais adicionais incluem perda de apetite, náusea, e vômito.
Assinar:
Postagens (Atom)